Alessio Cortelazzo,1,2 Claudio De Felice,3 Alessandra Pecorelli,1,4 Giuseppe Belmonte,5 Cinzia Signorini,4 Silvia Leoncini,1,4 Gloria Zollo,1,4 Antonietta Capone,6 Cinzia Della Giovampaola,6 Claudia Sticozzi,7 Giuseppe Valacchi,7,8 Lucia Ciccoli,4 Roberto Guerranti,2 Joussef Hayek1 U.O.C. di Neuropsichiatria Infantile, Policlinico “Le Scotte” Azienda Ospedaliera Universitaria Senese, (AOUS), Viale M. Bracci 16, 53100 Siena.
1 U.O.C. di Neuropsichiatria Infantile, Policlinico “Le Scotte” Azienda Ospedaliera Universitaria Senese, (AOUS), Viale M. Bracci 16, 53100 Siena.
2 Dipartimento di Biotecnologie Mediche, Università degli Studi di Siena, Via A. Moro 2, 53100 Siena.
3 U.O.C. Terapia Intensiva Neonatale, Policlinico “Le Scotte” Azienda Ospedaliera Universitaria Senese (AOUS), Viale M. Bracci 16, 53100 Siena.
4 Dipartimento di Medicina Molecolare e dello Sviluppo, Università degli Studi di Siena, Via A. Moro 6, 53100 Siena.
5 Dipartimento di Scienze Mediche, Chirurgiche e Neuroscienze, Policlinico “Le Scotte” Azienda Ospedaliera Universitaria Senese, (AOUS), Viale M. Bracci 16, 53100 Siena.
6 Dipartimento di Scienze della Vita, Università degli Studi di Siena, Via A. Moro 2, 53100 Siena.
7 Dipartimento di Scienze della Vita e Biotecnologie, Università degli Studi di Ferrara, Via Borsari 46, 44100 Ferrara
8 Department of Food and Nutrition, Kyung Hee University, 1 Hoegi-dong, Dongdaemun-gu, 130-701 Seoul, South Korea
La ricerca di possibili nuovi markers per la diagnosi di malattie neurologiche e neurodegenerative implica un approfondimento biologico, biochimico e molecolare mirato all’individuazione di molecole segnale e/o delle loro alterazioni che indichino in modo obiettivo la presenza/assenza e la gravità della malattia.
Nel presente studio ci siamo focalizzati sulle alterazioni a carico della beta-actina, proteina ubiquitaria con un ruolo fondamentale in diverse funzioni cellulari che vanno dalla motilità, mantenimento della polarità e della forma alla regolazione trascrizionale. è interessante sapere che
- la beta-actina è una parte integrante del citoscheletro dei neuroni,
- che questa componente citoscheletrica è essenziale per il processo dello sviluppo dendritico e
- alterazioni a livello dendritico caratterizzano diverse sindromi associate a ritardo mentale.
Le nostre ricerche si sono concentrate sul globulo rosso quale modello d’ispirazione per le altre cellule: l’eritrocita possiede una forma geometrica semplice e regolare e contiene un network di proteine citoscheletriche e di membrana facilmente schematizzabile e profondamente conosciuto nei dettagli molecolari. I nostri studi, condotti associando tecniche di proteomica quali SDS-PAGE, 2-DE e Western blot (WB) con la spettrometria di massa e la microscopia confocale, hanno permesso di analizzare nel dettaglio l’espressione, lo stato di ossidazione e la distribuzione della beta-actina all’interno degli eritrociti delle pazienti con sindrome di Rett (RTT).
Già da alcuni anni le nostre indagini si sono focalizzate sulle proteine del globulo rosso e sul ruolo dello stress ossidativo (SO) nella RTT anche se mai prima d’ora avevamo studiato la RTT accoppiando diverse metodologie mirate allo studio di un’unica proteina. Le analisi sono state condotte su 20 pazienti con diagnosi clinica di RTT classica e con mutazione dimostrata del gene MECP2.
Con una prima analisi elettroforetica (SDS-PAGE con colorazione argentica) abbiamo evidenziato nel pattern proteico della membrana del globulo rosso RTT, una diminuzione significativa (P < 0.01) della beta-actina (banda 6) con una diminuzione di -1.93 ± 0.09 volte rispetto al controllo come media ± deviazione standard (variazione: da -2.09 a -1.78 volte rispetto al controllo), mentre le altre proteine principali (bande proteiche 1-5 e 7-9) non variavano (Fig. 1).
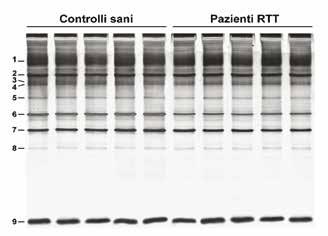
Fig. 1Espressione della beta-actina nelle membrane dei di RTT classica globuli rossi.
Analisi comparativa con SDS-PAGE dei globuli rosi e con mutazione “ghost” tra controlli sani e pazienti RTT.
E’ visibile la riduzione dimostrata del d’intensità per la beta-actina (banda 6) nei pazienti RTT.
Utilizzando anticorpi monoclonali che riconoscono sia l’intera sequenza aminoacidica (AA: 1-375) della beta-actina che le singole sequenze N- terminale (AA: 1-16) e C- terminale (AA: 364-375), abbiamo potuto riconfermare in modo più dettagliato la diminuzione della beta-actina nei globuli rossi RTT (Fig. 2).
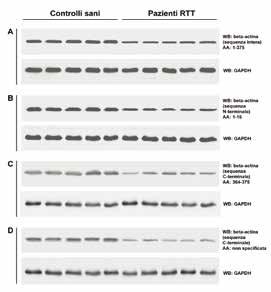 Fig. 2. Western blot con anticorpi anti-beta-actina.
Fig. 2. Western blot con anticorpi anti-beta-actina.
Analisi comparativa dei globuli rossi “ghost” tra controlli sani e pazienti RTT usando quattro anticorpi che riconoscono differenti sequenze aminoacidiche della betaactina (A: sequenza intera, B: sequenza N-terminale, C: sequenza C-terminale e D: sequenza C-terminale non specificata). L’espressione dei quattro anticorpi anti-beta-actina sono stati comparati all’espressione del controllo gliceraldeide-3-fosfato deidrogenasi (GAPDH).
Inoltre, abbiamo constatato che tale diminuzione è indipendente da possibili modificazioni post traduzionali (PTM) legate a specifiche sequenze di aminoacidiche che in qualche modo possono alterare il segnale della colorazione e/o il segnale anticorpale.
I risultati dell’analisi 2-DE/MALDI-TOF hanno evidenziato tre spots peptidici (isoforme) della beta-actina differentemente espressi sia nelle membrane dei globuli rossi dei pazienti RTT (Fig. 3A, pannello destro) che in quelle dei controlli (Fig. 3A, pannello sinistro).
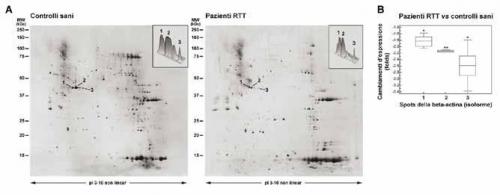 Fig. 3. Analisi 2-DE delle isoforme della beta-actina.
Fig. 3. Analisi 2-DE delle isoforme della beta-actina.
(A) Analisi comparativa tra pazienti RTT (pannello destro) e controlli sani (pannello sinistro). Le frecce indicano le isoforme della beta-actina diminuite nei pazienti RTT.
I due pannelli piccoli rappresentano una visione tridimensionale degli spot della beta-actina differentemente espressi. (B) Analisi quantitativa.
L’analisi quantitativa ha evidenziato una diminuzione significativa di ogni spot della beta-actina nei globuli rossi dei pazienti RTT (spot 1: -1.82 ± 0.15 fold; spot 2: -2.15 ± 0.06 fold; spot 3: -2.59 ± 0.48 fold) rispetto a quelli dei controlli sani (Fig. 3B).
Dato che la beta-actina è un componente essenziale del citoscheletro, la sua diminuzione può essere direttamente collegata a cambiamenti della forma cellulare. Come è noto, già da diverso tempo abbiamo evidenziato delle anormalità di forma dei globuli rossi nei pazienti RTT che avevano una prevalenza di leptociti circolanti. Questi presupposti ci hanno portato ad effettuare un’analisi comparativa al microscopio confocale, utilizzando un anticorpo anti-beta-actina, che ci ha permesso di evidenziare una disorganizzazione nella distribuzione e una diminuzione della beta-actina all’interno dei globuli rossi RTT (Fig. 4A) rispetto a quelli dei controlli sani (Fig. 4A).
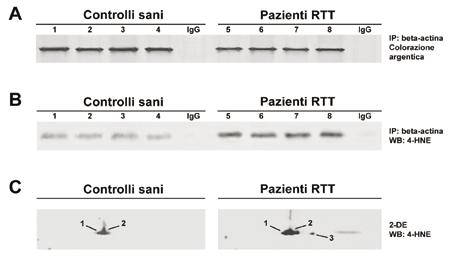 Fig. 4. Analisi di microscopia confocale sulla distribuzione della beta-actina nei globuli rossi dei pazienti RTT.
Fig. 4. Analisi di microscopia confocale sulla distribuzione della beta-actina nei globuli rossi dei pazienti RTT.
(A) Analisi comparativa che mostra le differenze dell’espressione e distribuzione della beta-actina tra pazienti RTT (pannello destro) e i controlli sani (pannello sinistro). I pannelli più piccoli mostrano una visuale piatta e tridimensionale di due eritrociti nei quali è evidente una differente distribuzione del segnale della beta-actina. (B) Analisi quantitativa del segnale della beta-actina nei controlli sani (C) e nei pazienti RTT.
Da tempo stiamo indagando sul ruolo dello SO nei globuli rossi dei pazienti RTT. Nel presente studio, per valutare l’entità dell’ossidazione della beta-actina, abbiamo immunoprecipitato (IP) (Fig. 5A) e successivamente, con un anticorpo anti- 4-idrossinonenale (4-HNE), effettuato analisi WB/SDS-PAGE (Fig. 5B) e WB/2-DE (Fig. 5C).
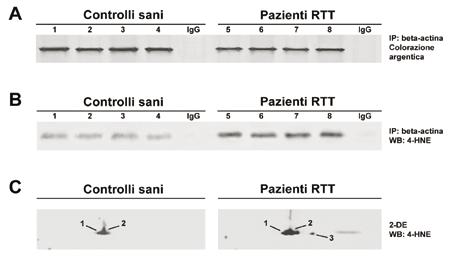 Fig. 5. Addotti del 4-HNE sulla beta-actina.
Fig. 5. Addotti del 4-HNE sulla beta-actina.
(A) SDS-PAGE (colorazione argentica) della beta-actina immunoprecipitata da globuli rossi di controlli sani (1-4) e pazienti RTT (5-8). (B) Analisi WB degli addotti del 4-HNE sulla beta-actina immunoprecipitata da globuli rossi di controlli sani (1-4) e pazienti RTT (5-8). Gli anticorpi (IgG) di coniglio sono serviti come controllo negativo. (C) WB/2-DE degli addotti del 4-HNE sulla beta-actina.
I risultati hanno mostrato un aumento dello SO a carico della beta-actina nei globuli rossi dei pazienti RTT, in particolare sulle tre isoforme identificate con la 2-DE.
In conclusione i nostri risultati dimostrano, per la prima volta, una diminuzione dell’espressione associata a PTM ossidative della beta-actina che appare distribuita in modo irregolare nell’interfaccia interna della membrana dei globuli rossi dei pazienti RTT. Inoltre la nostra ricerca dimostra che un approccio multi-metodologico sulla RTT è in grado di rivelare effetti a cascata provocati da un difetto funzionale del MeCP2 e quindi di identificare potenziali nuovi bersagli terapeutici per la malattia.
Il presente studio è stato finanziato dalla Regione Toscana [Bando Salute 2009; “Antioxidants (ω-3 Polyunsaturated Fatty Acids, lipoic acid) supplementation in Rett syndrome: A novel approach to therapy “].
*Riferimento alla pubblicazione originale:
Cortelazzo* A, De Felice* C, Pecorelli A, Belmonte G, Signorini C, Leoncini S, Zollo G, Capone A, Della Giovampaola C, Sticozzi C, Valacchi G, Ciccoli L, Guerranti R, and Hayek J (2014) Beta-Actin Deficiency with Oxidative Posttranslational Modifications in Rett Syndrome Erythrocytes: Insights into an Altered Cytoskeletal Organization. PLoS One, In Press.

