L’intervento del dottor Lotan Mair ha illustrato il caso di una bambina in cui il trattamento con il farmaco Pamidronate è stato in grado di invertire il progredire dell’osteoporosi
Lotan Meir
Chaim Sheba Medical Center, Tel HaShomer, Ramat Gan Israeli Rett Center, National Evaluation Team, e Department of Physical Therapy, Ariel University, Ariel, Israel
Traduzione Prof. Franco Pisani, Roma
Sommario
Quadro generale:
L’osteoporosi è la riduzione dei livelli di densità del calcio nelle ossa, di solito evidente nelle donne post-menopausa. Tuttavia la tendenza all’osteoporosi può essere individuata già in giovane età, specialmente in pazienti con malattie croniche e disabilità, e in coloro che assumono cronicamente farmaci anticonvulsivanti. Nei soggetti con la sindrome di Rett (SR) si sono riscontrati segni di osteoporosi già in giovane età. Questa condizione può provocare fratture patologiche, causare dolore e danneggiare gravemente la mobilità e la qualità della vita dei bambini.
L’articolo presente:
Il presente articolo descrive il caso di una bambina con osteoporosi grave e fratture multiple, prima e dopo il trattamento con Aredia.
Il trattamento:
Una dose di 30mg/giorno di Pamidronate è stata iniettata per via endovenosa per la durata di tre giorni, una volta ogni tre mesi.
Risultati:
C’è stato un miglioramento del 45% nei valori BMD dal test I al test II. Questa variazione è considerata statisticamente significativa. La bambina non ha avuto fratture negli ultimi 3 anni post trattamento, rispetto ad una media di 1,75 fratture all’anno, nei 4 anni precedenti il trattamento. Anche questo dato è statisticamente significativo (P<0.03). La bambina, con valori Z-scores di BMD, mostrava osteo-porosi grave alle misurazioni pre-intervento (3.8-) e valori ridotti a livello di osteopenia (-1.3) a quelle post-intervento.
Discussione:
Tutte le misurazioni indicano che il trattamento è riuscito a invertire il processo osteoporotico e la bambina non ha più avuto altre fratture. Questo cambiamento è stato di grande sollievo per la bambina e la sua famiglia, e ha significato un miglioramento nella qualità di vita.
I dati rilevati confermano la capacità (in questo caso) di invertire il progredire dell’osteoporosi, in soggetti con la sindrome di Rett che mostrano osteoporosi grave con fratture multiple.
Introduzione
Che cos’è l’osteoporosi?
L’osteoporosi (Osteo = osso, Porosis = pori) fu concordemente definita nel 1993 durante una conferenza come “una malattia sistemica dello scheletro, caratterizzata da una bassa massa ossea e da deterioramento micro-architetturale del tessuto osseo, con conseguente aumento della fragilità e del rischio di fratture” [1]. Di solito le popolazioni a rischio di osteoporosi sono le donne in età di menopausa; tuttavia la tendenza all’osteoporosi si può individuare già in giovane età [1], anzi ora possiamo associare la tendenza all’osteoporosi in età adulta al mancato raggiungimento della massa ossea massima in giovane età [1].
Un altro dato rilevato conferma il fatto che i bambini affetti da malattia cronica sono anche una popolazione a rischio di osteoporosi [2].
è stato riscontrato che il 10% dei bambini con diagnosi di malattia cronica potrebbero sviluppare l’osteoporosi in giovane età (da 3 a 18) per effetto dell’immobilià e della scarsissima esposizione alla luce solare [3]. A causa delle suddette condizioni, questa popolazione è ad alto rischio di fratture ossee [4].
L’osteoporosi e le fratture sono le cause principali di lesioni, disabilità di lungo periodo e persino di morte [5], specialmente per individui con disabilità [4, 6].
I bambini in condizioni di disabilità sono predisposti alle fratture delle ossa lunghe, che si verificano al minimo trauma [4, 6]. Si è riscontrato che la densità della massa ossea (BMD è l’acronimo inglese), che in pratica equivale alla forza dell’osso, era ridotta nei bambini con disabilità, rispetto ai valori dei loro coetanei sani [7-9]. Dati simili sono stati riscontrati nella popolazione di bambini con SR [10].
L’osteoporosi nella SR
I fattori generali di rischio per sviluppare l’osteoporosi sono (i fattori di rischio tipici della SR sono riportati in grassetto): donne e uomini in età avanzata, magrezza costituzionale, fumo, irregolarità nelle mestruazioni, elevato consumo di caffeina, elevato consumo di bevande alcooliche, storia familiare di osteoporosi, alimentazione povera di calcio, elevato consumo di sali e proteine, stile di vita sedentario, cessazione precoce delle mestruazioni, donne che non hanno mai partorito, uso di particolari medicine come farmaci anti-convulsivi.
Oltre ad appartenere a questo gruppo di bambini con malattia cronica, le persone con SR sono esposte ai seguenti fattori di rischio: esse non svolgono attività fisica (particolarmente le non-
deambulanti), nel 30-90% di loro si prevede lo sviluppo di epilessia e dovranno pertanto assumere farmaci anti-convulsivi [11- 15], molte di loro mostrano irregolarità mestruali [16].
Quando si considera il rischio di subire fratture dovute ad osteoporosi, si nota che gli individui con SR sono di nuovo svantaggiati.
Nel suo articolo, Heaney [17] cita i seguenti fattori: le cadute, mancanza di cuscinetti di tessuto molle, inappropriate reazioni posturali, mancanza di forza ossea, e alimentazione scarsa; essi sarebbero i maggiori elementi che contri-buiscono al verificarsi di fratture, e questi fattori sono comuni tra individui con SR.
In realtà, il fatto che gli individui con SR siano a rischio di sviluppare osteoporosi fu stabilito dalla Haas e dai suoi collaboratori. Questo gruppo di ricercatori ha messo a confronto la densità ossea minerale, il contenuto osseo minerale, e la densità minerale della spina dorsale di 20 giovani soggetti femminili con SR, con i valori di 11 giovani con C.P. e con i valori di 25 soggetti di controllo, senza alcuna patologia, e ha riscontrato valori significativamente ridotti nei soggetti con SR. Tenendo conto delle differenze di età e di peso, si è riscontrato che gli individui con SR mostravano densità ossea inferiore a livello di osteopenia (v. spiegazione più avanti), in confronto agli altri gruppi [10]. I dati rilevati sono stati confermati anche da altri gruppi [18, 19].
Budden e Gunness hanno ottenuto risultati simili in uno studio di cinque bambine con SR, ipotizzando che una lenta formazione ossea, in giovane età in individui con SR, possa alla fine causare bassa densità ossea in questa popolazione. Hanno anche ipotizzato che l’influenza dell’MECP2 (il gene responsabile della SR) non si limiti a danneggiare i tessuti cerebrali, e che questi dati fuori norma, riscontrati nello sviluppo osseo, siano causati dall’effetto diretto del gene mutato MECP2 sul gene SR dello sviluppo osseo [20]. Mentre la frequenza delle fratture non è stata studiata clinicamente in questa popolazione, sembra che ci sia un’incidenza maggiore, a confronto con individui senza SR [21].
Diagnosi dell’osteoporosi
In assenza di metodi atti a misurare la qualità dell’osso, si tende ad effettuare la diagnosi di osteoporosi sulla base della bassa densità ossea [22]. Dal momento che il 75% della forza dell’osso è determinato dalla sua densità, questo metodo è considerato un buon indicatore per la diagnosi di osteoporosi.
I gradi dell’osteoporosi vengono definiti secondo il rapporto tra l’effettiva densità ossea, riscontrata nel paziente, e la densità prevista nella popolazione di appartenenza (T-score).
1. Una BMD normale è definita con un T-score tra +2.5 e –1.0; vale a dire: la BMD del paziente si trova tra 2.5 deviazioni standard (SD), sopra la media di giovane adulto, e una deviazione standard (SD) al di sotto della media di giovane dadulto.
2. L’osteopenia (BMD bassa) è associata con un T-score tra –1.0 e –2.5, inclusi. Osteopenia è anche un termine usato dai radiologi ad indicare che le ossa, su un semplice film da raggi X, appaiono con un diminuito contenuto minerale.
3. L’osteoporosi viene definita co-me un T-score inferiore a –2.5. [23].
Si stima che l’abbassamento di un SD attorno alla spina dorsale aumenti l’eventualità di una frattura del 190%.
L’abbassamento di un SD attorno al collo del femore aumenta l’eventualità di frattura del 240%.
Si stima che l’abbassamento di due e mezzo SD aumenti l’eventualità di frattura del 600-800%, rispetto a quanto previsto per il rispettivo gruppo di appartenenza.
Metodi comuni per la diagnosi dell’osteoporosi:
Le tecniche per la misurazione dell’osso si possono dividere in:
tecniche che misurano lo SCHELETRO CENTRALE (spina dorsale, parte prossimale del femore, scheletro intero, ecc.)
tecniche che misurano qualche parte dello SCHELETRO PERIFERICO.
La misurazione dello SCHELETRO CENTRALE viene quasi sempre effettuata usando:
Assorbimetro a raggi X a duplice energia (DEXA/DXA), che si basa su radiazioni di raggi X a basso livello. Con questo metodo, la densità ossea viene misurata in due siti (spina dorsale e anche). Già a Livello 1 si ha la prova che la misurazione ossea con metodo DXA è il modo più efficace di valutare il rischio di fratture [24]
La Misurazione della forza nello SCHELETRO PERIFERICO mediante ecografia quantitativa (QUS) è una tecnica notissima. Si ottiene misurando la velocità delle onde sonore lungo l’osso in esame. Si ha la prova che la QUS fornisce misurazioni della densità ossea che possono essere impiegate per valutare il rischio, con precisione simile alla DXA, nelle popolazioni anziane [25], come pure nei bambini con CP [26].
Per quanto riguarda altre tecniche per la misurazione della densità ossea periferica, come la tomografia quantitativa periferica (pQCT), la DXA radiale e del calcagno DXA, l’assorbimetro radiografico, si è riscontrato che esse si differenziano tra quelle con e quelle senza prevalenti fratture in donne post-menopausa caucasiche (cioè con pelle chiara) [27].
Intervento sull’osteoporosi in individui con SR
L’osteoporosi costituisce un problema multi-disciplinare, che richiede diagnosi e un intervento organizzato appropriati. Per raggiungere un buon livello gestionale, è necessaria una continua consulenza con gli esperti adeguati (un medico generico, un dietologo e un fisioterapista).
I passi base di tale programma anti-osteoporotico devono comprendere: una valutazione approfondita del soggetto con SR, al fine di confermare o escludere la diagnosi di osteoporosi/osteopenia e, nel caso si renda necessario, l’introduzioone di un programma comprensivo.
Tale programma deve comprendere:
Appropriati cambiamenti dietetici
Aumento della mobilità, del movimento e del rafforzamento, tenendo conto dei limiti personali (se il paziente non può muoversi, allora bisogna applicare un programma giornaliero di esercizio su posizione eretta) e infine,
Esposizione delle bambine alla luce solare.
Gli autori ribadiscono il richiamo, già avanzato da precedenti ricercatori, per implementare un programma multicomponente, anti osteoporosi, per individui con SR, iniziando dalla giovane età.
Gestione del’osteoporosi in individui con SR
Che cosa influenza la forza delle ossa?
Circa l’80% della massa ossea è determinata da elementi ereditari, mentre il restante 20% viene determinato da cause ambientali e dallo stile di vita. Malgrado il fatto che soltanto uno, dei molti fattori che contribuiscono alla salute delle ossa, rientri sotto il nostro controllo, questi fattori possono avere un effetto significativo sulla costruzione delle ossa, in giovane età, e sulla loro distruzione [28].
Nella popolazione normale, due elementi principali determinano il livello di calcio nelle ossa e più avanti il livello di osteoporosi: la massa ossea massima, raggiunta nel corso dell’adolescenza, e il tasso di perdita di calcio nell’età adulta [29].
 Gestione dell’osteoporosi
Gestione dell’osteoporosi
Le fratture causate dalla fragilità osteoporotica si possono prevenire con programmi di intervento multidisciplinare [30]. La sostanza ossea è costituita da proteine e minerali. Non sorprende pertanto che il fondamento di qualsiasi programma medico, di carattere terapeutico o preventivo, debba necessariamente basarsi su un’adeguata assunzione dietetica delle seguenti sostanze vitali: proteine di elevata qualità, calcio, fosforo, [17] il tutto accompagnato da esercizio fisico.
Le caratteristiche cliniche della sindrome di Rett richiedono un intervento aggressivo, per migliorare al massimo la qualità della vita degli individui colpiti. [19].
Ci sono 3 importanti fattori in grado di influenzare la forza delle ossa, e pertanto un programma di intervento deve basarsi sui seguenti punti:
Farmaci
Alimentazione (con particolare riguardo al calcio e alla vitamina D)
Esercizio fisico.
A. Farmaci
La presente sezione non entrerà in dettagliate descrizioni dei farmaci appropriati nel caso dell’osteoporosi, ma riporterà soltanto le possibilità di carattere generale.
Trattamento ormonale con estrogeni – Si è riscontrato che il consumo di estrogeni impedisce l’ulteriore deterioramento delle ossa e previene persino le fratture, ma per divenire effettivo questo trattamento deve durare oltre tre anni. Di recente si è appreso che questa forma di intervento potrebbe in qualche modo aumentare il rischio di altre malattie, e quindi non è più considerato un trattamento adeguato per la riduzione e la prevenzione dell’osteoporosi.
Ormone Kalcytonine (Miacalcic) – Questo ormone, prodotto dalla giandola pituitaria, arresta gli osteoclasti (cellule che distruggono il tessuto osseo), prevenendo così l’assorbimento osseo. Questo trattamento è efficace quanto il trattamento con estrogeni, poiché riduce I dolori dorsali causati da vertebre fratturate o incrinate. è anche altamente raccomandato per le popolazioni non-mobili, ed è quindi ancor più adatto per i soggetti affetti da SR.
Raloxifen (Evista) – Questa famiglia di farmaci migliora la densità ossea del 2% nell’arco di due anni nel 60-70% dei pazienti. Riduce anche l’eventualità di fratture ossee (tra 10-50% secondo differenti pareri) [28].
Bifosfonati – Questo gruppo di farmaci anti-riassorbimento di solito viene raccomandato solo quando si osserva un grave calo nella massa ossea oppure quando I trattamenti a base di ormoni non danno alcun miglioramento. Si è riscontrato che queste medicine riducono del 45-50% le fratture alle vertebre e al collo del femore. Questi farmaci (specialmente il Foslan) non vengono assorbiti con facilità attraverso l’apparato digerente e il loro coonsumo deve essere valutato attentamente prima della prescrizione, particolarmente negli individui che mostrano difficoltà nel deglutire e nel digerire (come nel caso di molti con SR) [15, 31, 32]. In questa famiglia di farmaci si trovano il Pamidronate, Alendronate e l’Opadronate, che si è rivelato utile nel diminuire il rischio di fratture [33]. Nonostante che i Bisfosfonati siano in uso da 25 anni, per bambni e adolescenti, il loro impiego non è stato regolare, e viene documentato principalmente da studi su casi singoli. Tuttavia, è stato documentato l’impiego di questi farmaci con pazienti con SR [34]. Sulla base di nuovi dati raccolti, i ricercatori raccomandano l’uso dei farmaci per riassorbimento osseo, nel caso di individui con SR [19].
Agenti Anabolici – Gli agenti sono considerati un importante sviluppo degli ultimi anni, per la terapia anti-osteoporosi [17]. Il teriparatide viene somministrato per via sottocutanea, su base giornaliera. Quando la terapia è adeguatamente integrata con calcio e vitamina D, la produzione di teriparatide aumenta la massa ossea dal 10% al 15% su base annua [40, 41]. Ancor più importante, riduce di due terzi il rischio di tutte le fratture vertebrali, e di circa l’85% quello di gravi e multiple fratture vertebrali [35]. Esso riduce anche di circa il 50% il tasso di fratture non vertebrali. Quando è stato somministrato in combinazione con estrogeni, il teriparatide ha aumentato del 30% la densità ossea della spina dorsale, e del 12% la densità ossea dell’anca, durante un periodo di due anni [36]. Dal momento che questo agente è molto nuovo, di fatto non esistono descrizioni: probabilmente l’impiego del teriparatide verrà inizialmente concentrato su pazienti con osteoporosi grave, il trattamento durerà probabilmente da 18 a 24 mesi e alla fine di questo periodo ci sarà il passaggio ad un agente anti-riassorbimento [17].
B. Alimentazione
Anche con adeguati farmaci l’osso non si ricostituirà se vi sarà un bilancio negativo di azoto e minerali, a causa di inadeguata assunzione di queste sostanze. [17]. Un’alimentazioe ben equilibrata include un’ampia gamma di alimenti, che possano costituire un valido ausilio nel mantenere costantemente in ottimo stato la forza e la salute delle ossa.
Calcio – Il calcio contiene il 67% del peso osseo e quindi gioca un ruolo importante nel mantenere la forza delle ossa. Il calcio è una parte importante nel processo di ricostruzione delle ossa lunghe e la sua presenza nelle ossa costituisce anche una riserva per altri sistemi/organi che richiedono questo elemento (come il cuore, muscoli, sangue e sistema nervoso). Pertanto è importante mantenere alti livelli di assunzione di calcio, come valido ausilio per costituire la massa ossea durante l’infanzia e mantenerla durante l’adolescenza e l’età adulta, in modo di assicurare il corretto funzionamento degli organi vitali. Malgrado il calcio, di per sé, non sia in grado di prevenire la riduzione della massa ossea, esso rappresenta comunque la parte cruciale di ogni intervento mirato a prevenire e trattare l’osteoporosi. Le dosi raccomandate di calcio, a differenti età, sono specificate nella tabella seguente, in conformità alle direttive internazionali (http://www.nap.edu) (Tabella N. 1).
Al fine di aiutare gli individui con SR ad assumere la giusta quantità di calcio, il prospetto seguente riporta le diverse sostanze nutritive in relazione al calcio.
Vitamina D – La vitamina D è prodotta nei reni. è un elemento importante per l’assorbimento del calcio attraverso l’intestino. La Vitamina D è assunta integrando la dieta con pesce sott’olio, uova, latte e margarina. Il modo migliore di aumentare la produzione di vitamina D è di esporre le pelle alla luce del sole, limitando comunque l’esposizione alle prime ore della mattina e al tardo pomeriggio, per evitare danni alla pelle, dovuti a sovraesposizione.
La vitamina D è un importante integratore per individui non attivi. La dose raccomandata è di 200 IU (5 mg), adatta ad individui fino a 50 anni [37]. A questo proposito ripetiamo ancora che si sono riscontrate notevoli riduzioni nel numero di fratture, all’anca ed altre estremità, nel periodo da 18 a 36 mesi dall’inizio dell’assunzione di calcio e vitamina D, nelle quantità sopra riportate [38].
Integratori – Gli integratori alimentari, diversi dal calcio e vitamina D, raccomandati come intervento preventvo, e anche come mezzo per migliorare la condizione osteo-porotica, sono: Magnesio, Vitamina B6, Acido folico, Vitamina B12, Anidride silicica, Fluoruro, Fito estrogeni.
Integratori sconsigliati – Si è riscontrato che diversi cibi e integratori impediscono l’assorbimento del calcio, per cui è opportuno considerarne la riduzione delle dosi. Ecco alcuni esempi:
Fitati – si possono trovare in diverse fibre (es. Frumento non raffinato);
Tannino – si trova nel tè;
Ossalato – negli spinaci;
Caffeina – nel caffè e nelle bibite analcooliche a base di cola;
Alcool – presente in vari prodotti;
Fosfato – nelle bevande analcooliche.
Alcune sostanze alimentari aumentano la presenza di calcio nelle urine: sali, cibi altamente proteici e caffeina.
Ricordiamo ancora la necessità di consultare sempre un dietologo prima di effettuare qualsiasi cambiamento nell’alimentazione.
C. Esercizio fisico
La riabilitazione muscolo-scheletrica deve essere sempre considerata in collegamento con il trattamento farmaceutico, al fine di ottimizzare la salute muscolo-scheletrica, di migliorare la qualità di vita, e ridurre il rischio di fratture e ricorrenza di fratture [30]. Da lungo tempo è stato accertato che le strutture ossee del corpo, per rimanere forti e sane, hanno bisogno di nutrimento e di adeguato sforzo meccanico, derivante da attività fisica [39]. L’esercizio fisico quotidiano aiuta a mantenere forti le ossa e i muscoli, a conservare flessibilità e a ridurre l’eventualità di lesioni.
è stato accertato che le donne che sono più attive hanno maggiore densità ossea e minori eventualità di fratture, rispetto alle donne della stessa età ma inattive [40]. Nel caso di individui con disabilità come la SR, la scarsità di attività fisica svolta fin dalla prima infanzia esporrà questa popolazione ad una carente processo di sviluppo dell’osso. Coloro che prestano le cure dovranno pertanto cogliere ogni opportunità per condividere uno stile di vita attivo, in modo che la bambina possa raggiungere un livello massimo di attività. Nondimeno, bisogna ricordare che si è riscontrato che un carico meccanico di bassa ampiezza [41] migliora la densità ossea, e che un programma di questo tipo ha effettivamente migliorato la densità della massa ossea in un gruppo di bambini disabili [42]. Nonostante la convinzione comune che il miglioramento della densità ossea avvenga solo quando viene eseguito un programma quotidiano di intensità minima di 2 ore con posizione eretta, è stato accertato che anche un tempo medio di posizione eretta, di meno di 4,5 ore alla settimana per ogni partecpante, migliora il valore BMD nella spina dorsale dei bambini con Paralisi Cerebrale Infantile [43].
Per gli individui senza disabilità, due tipi di esercizi sono particolarmente benefici per lo sviluppo delle ossa in giovane età – esercizi di carico ed esercizi di rinforzo muscolare. Esempi di tali esercizi sono: camminare, jogging, netball, ballare, tennis, golf, esercizi di rinforzo muscolare attivo o contro resistenza. Sfortunatamente, gli individui con SR non saranno in grado di esercitare a maggior parte o nessuna delle suddette attività.
Esercizio fisico nella SR
Se si applica un programma di esercizio fisico a soggetti con SR, bisogna attenersi alle seguenti regole:
alimentazione appropriata – consultare un dietologo
Iniziare lentamente e procedere con gradualità
Esecuzione o supervisione del programma da parte di un fisioterapista
Includere esercizi di carico osseo che inducano la struttura ossea ad accrescersi e a rinforzarsi (il nuoto ha tutti gli elementi positivi dell’esercizio fisico, però non favorisce né il rafforzamento né la crescita delle ossa).
Includere esercizi di rinforzo della muscolatura dorsale al fine di aumentare la forza della muscolatura posteriore del tronco, in considerazione del fatto che si è rilevata una connessione tra persone con osteoporosi e muscolatura dorsale debole [44, 45].
Includere un training propriocettivo-dinamico-posturale (PDPT) per migliorare la postura e l’equilibrio [46].
Introdurre una modalità routinaria (il programma di attività fisica dovrebbe essere svolto almeno per tre ore alla settimana) tenendo in considerazione le limitazioni mediche degli individui con SR
Non demordete! (almeno a livello minimo – cercate di far sì che sia la bambina stessa a metterci un po’ di sforzo).
Cercate di variare (di tanto in tanto cambiate l’esercizio, per rendere il programma più interessante, e cambiate anche la pressione esercitata sulle ossa).
Includere strategie per la prevenzione delle cadute, nel caso che la bambina sia deambulante (si è riscontrato che la combinazone di inattività e funzione neuromuscolare indebolita provoca fratture connesse alle cadute) [47].
Allegria! (es. cantate insieme con la bambina, aggiungete al programma la presenza di un cane, ecc.).
Lavorare in gruppo (es. chiamare coetane o familiari).
Non provocare dolore (osservare attentamente il viso della bambina) [29].
Per gli individui che hanno già sofferto di fratture patologiche nel passato, è stato stabilito (per gli adulti più anziani) che la riabilitazione, dopo fratture causate da osteoporosi, debba comprendere esercizi intesi ad aumentare la forza muscolare, diminuire il rischio di cadute, includere esercizi per il rafforzamento dorsale, per migliorare la postura, e eseguire terapia fisica sedativa, per diminuire il dolore collegato a deficit posturale [30]. Questa tipologia di esercizi dovrebbe essere considerata una linea di riferimento per gli individui con SR, nel caso che abbiano avuto una diagnosi di frattura osteoporotica. è inoltre molto probabile che la bambina mostri paura del movimento, nel qual caso lei irrigidirà il proprio corpo, esercitando resistenza muscolare sulle sue fragili ossa. è una situazione complessa che richiede interventi delicati.
A. è necessario concordare un programma bilanciato tra i genitori e l’équipe curante.
B. Il programma deve stabilire il massimo movimento possibile pur con la massima cautela
C. Ci dovrà essere un appropriato equilibrio tra la gestione della parte alimentare e quella medica.
D. Il programma deve comprendere una fase preparatoria in modo da calmare la bambina e far rilassare I suoi muscoli irrigiditi.
E. La bambina dovrà essere avvertita verbalmente prima di effettuare qualsiasi movimento.
F. Si raccomanda di sviluppare il programma in un’atmosfera rilassata, sul modello di un ambiente Snoezelen [48, 49].
G. Bisogna includere nel programma anche le consuete pratiche quotidiane (come fare il bagno, vestirsi e svestirsi), e anche i movimenti degli arti e del tronco.
H. Nel corso di tutta la giornata bisogna modificare le posture della bambina, lentamente e con prudenza (per es. usando statiche, panche, cuscini, ecc.) [50].
Comunque, in certi casi l’osteoporosi è veramente grave, la bambina subisce una serie di fratture che causano dolore, e non è possibile un intervento terapeutico paramedico, con una grave riduzione della qualità della vita, per la bambina e per la sua famiglia.
L’articolo presente
Il presente articolo descrive un nuovissimo intervento medico in una bambina che mostrava una osteoporosi grave con fratture multiple.
Procedura
Con procedura IRB la madre della bambina ha autorizzato la raccolta e la classificazione dei documenti medici. La madre ha firmato un consenso informato e lo ha consegnato all’autore del presente studio. Tutto il materiale raccolto è stato sistemato e valutato cronologicamente, in modo da comporre la storia del caso.
La bambina – Studio del caso
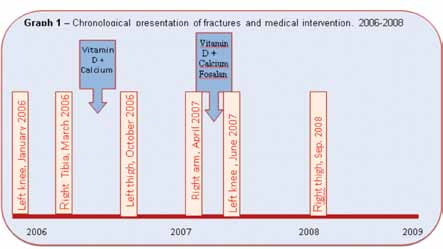
M.T è nata nel 2001; le fu diagnosticata la SR, clinicamente all’età di 16 mesi e geneticamente all’età di 18 mesi. Ha acquisito poche tappe di sviluppo, ed è confinata su un passeggino o carrozzina. Secondo i dati anamnestici ha iniziato a manifestare ripetute fratture, derivanti da traumi di basso impatto (gennaio, marzo 2006) ed è stata sottoposta ad indagini metaboliche. I dati iniziali rilevati indicavano un valore Z-score di 3.8- indice di osteoporosi grave. Dopo il fallimento dell’intervento medico iniziale (assunzione di Vitamina D e di Calcio e aumento dell’assistenza paraprofessionale – ippoterapia, terapia fisica, occupational therapy), e dopo altre fratture della stessa natura (ottobre 2006, aprile 2007), è stato intensificato l’intervento convenzionale, aggiungendo Fosalan (il Fosalan (Osteofos) si trova in una classe di farmaci chiamati bisfosfonati; esso funziona prevenendo il riassorbimento osseo, accrescendo così la densità ossea, aumentando anche la forza ossea e riducendo la probabilità di fratture). Dopo due ulteriori fratture (giugno 2007, settembre 2008), fu suggerito un nuovo tipo di intervento, comprendente l’assunzione di Pamidronate (aminohydroxypropylidene diphosphonate disodium).
Il farmaco
Il Pamidronate (aminohydroxypro-pylidene diphosphonate disodium) è un farmaco indicato per patologie del ciclo di rinnovo osseo. Si può assumere oralmente oppure per via endovenosa. Il Pamidronate è stato riconosciuto utile in diverse malattie che comprendono processi osteopatologici, poiché rallenta l’assorbimento osseo. è stato accertato che il farmaco riduce il dolore, migliora la mobilità e riduce i rischi di fratture nelle donne in menopausa [51].
Protocollo terapeutico Aredia
Il farmaco è stato introdotto per via endovenosa, in ambiente ospedaliero, con un dosaggio di 30 mg/giorno, per la durata di tre giorni, una volta ogni tre mesi. Durante l’assunzione del farmaco sono stati testati campioni di sangue per Urea, Calcio, Magnesio e Sodio. Pressione e polso venivano costantemente misurati.
Misurazioni
Come indice per valutare I progressi di M.T., a seguito del trattamento medico ricevuto, si possono utilizzare le seguenti misurazioni.
Densità ossea – valori
I valori normali di densità minerale ossea, per un soggetto femmnile dell’età di 5.5 anni (primo test) sono 0.65-0.42, mentre i valori normali, di densità minerale ossea, di una fanciulla bianca di 9 anni (secondo test) sono 0.8-0.48.
Variazione nei dati rilevati dal primo test a quello successivo
La variazione dei dati rilevati, dal primo test a quello successivo, è considerata statisticamente significativa se è maggiore del 3%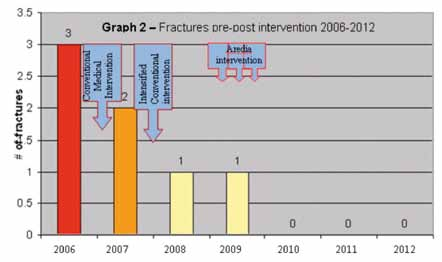 .
.
Numero di fratture
Il numero di fratture prima e dopo l’intervento può essere usato per valutare l’esito dell’intervento.
Risultati
Negli ultimi tre anni, dopo il termine dell’intervento Aredia, M.T. non ha più avuto nessuna frattura (Graph 2). I valori Z-scores di densità minerale ossea sono migliorati, da -3.6 a -1.3 indicando una densità ossea a livello di Osteopenia (Tabella 1). Nel corso del prossimo anno la bambina dovrà sottoporsi ad un altro trattamento Aredia, per mantenere il livello di densità ossea.
Discussione
M.T. Non ha più sofferto nessuna frattura nei tre anni dopo il termine di questo nuovissimo intervento medico.
Come già suggerito in precedenza, la sua condizione potrebbe essere valutata mediante tre misurazioni:
Valori di densità ossea– I valori iniziali di BMD (0.33), rilevati per la bambina M.T., la collocavano al di sotto della norma, a livello di osteoporosi grave. Il secondo test (0.49) la collocava su valori normativi inferiori di BMD (Osteopenia), indicando un cambiamento significativo rispetto alle condizioni pre e post intervento.
Variazione nei dati rilevati dal primo test a quello successivo – Il cambiamento nei dati rilevati, dal primo test a quello successivo, è stato accertato al 49.5%+ e può essere considerato statisticamente significativo.
Numero di fratture – Il cambiamento, dal numero di fratture pre-trattamento (una media di 1.75 fratture per anno) al numero di fratture post-trattamento (una media di 0 fratture per anno) è stato considerato statisticamente significativo (P<0.03).
Tutti i test, pre e post intervento, indicano che la condizione di M.T. è migliorata, ma il cambiamento più importante sta nel fatto che M.T. e la sua famiglia possono riprendere una vita relativamente normale, senza continui problemi medici e ricoveri ospedalieri. I suoi genitori possono riprendere una qualità di vita meno stressante, e M.T. può riprendere la scuola con frequenza regolare, qualcosa che non aveva più provato, da quando cominciò a soffrire di frequenti fratture, all’età di 5 anni.
Limiti
Il presente articolo presenta lo studio su un caso singolo e non si può generalizzare troppo. Ricordiamo pertanto che programmi di questo genere devono essere applicati con cautela.
Conclusione – Intervento per osteoporosi su individui con SR
L’osteoporosi costituisce un problema multi-disciplinare che richiede una diagnosi e un intervento organizzato appropriati. Per raggiungere un buon livello gestionale, è necessaria una continua consulenza con gli esperti adeguati (un medico, un dietologo, e un fisioterapista).
I passi base di tale organizzazione anti-osteoporotica devono comprendere una valutazione approfondita del soggetto con RS, al fine di confermare o escludere la diagnosi di osteoporosi, e nel caso si renda necessario un intervento, la proposta di introdurre un programma articolato.
Il programma deve comprendere appropriati cambiamenti dietetici, aumento della mobilità, del movimento, e del rafforzamento, tenendo conto dei limiti personali (se il soggetto non può muoversi, allora sarà necessario applicare un programma giornaliero intensivo di statica ed esposizione alla luce solare.
Il presente articolo indica che anche in casi di fratture patologiche, dovute a osteoporosi grave, un intervento medico intensivo può invertire la condizione ossea osteoporotica, prevenire fratture e migliorare la qualità di vita della bambina e della sua famiglia. Un programma di questo tipo può anche incrementare la partecipazione della bambina in ambienti educativi consentendole un accesso continuativo a programmi educativi e terapeutici.
| Tabella 1 – Livelli normali di calcio a differenti età e sesso | ||
| Categoria | Età | Calcio (mg) |
| Bambini | 1-3 anni | 500 |
| 4-7 anni | 800 | |
| Ragazze | 8-18 anni | 1300 |
| Donne | 19-54 anni | 1000 |
| 51+ anni | 1200 | |
| Ragazzi | 8-11 anni | 1300 |
| 12-15 anni | 1300 | |
| Tabella 2 – Cambiamento nelle misurazioni ossee pre-post intervento | ||||||||
| Misurazioni | Z-scores | BMD | T-scores | Cambiamento dal test I | ||||
| Test I (age 5.5) | 3.8- | 0.33 | -6.5 | |||||
| Test II (age 9) | -1.3 | 0.49 | —— | ** 49.5%+ | ||||
| Index: | Z scores – SD difference in comparison to normative findings at same age | T Score – SD difference between measured value and normative findings at age 25 | BMD – Bone Mineral Density (gr/sm2) | **A change of 3% is considered statistically significant | ||||
 Un gruppo di famiglie presenti al convegno
Un gruppo di famiglie presenti al convegno
BIBLIOGRAFIA
1. Consensus development conference (1993): diagnosi, profilassi e trattamento dell’osteoporosi. Am J Med 94, 646-650.
2. Zacharin, M.(2004) Progressi attuali per la salute ossea dei bambini disabili. Curr. Opin. Pediatr. 16(5), 545-551.
3. Hartman, C., Brik, R., Tamir, A., Merrick, J., e Shamir, R. (2004) Ecografia ossea quantitativa e condizione dell’alimentazione nei bambini e adolescenti gravemente andicappati e ospiti in istituti. Clin. Nutr.23(1), 89-98.
4. Gray, B. (1992) Fratture causate da cadute dalla sedia a rotelle in pazienti con malattia neuromusculare. Dev Med Child Neurol.34, 589-592.
5. Sahaf, M. (2005) Osteoporosi – La malattia, diagnosi e gestione. (Hebrew). Shenbon, The religious college for education; 8, 152-153.
6. Lingam, S., e Joester, J. (1994) Fratture spontanee nei bambini e adolescenti con paralisi cerebrale. BMJ 309, 265.
7. Kovanlikaya, A., Loro, M., Hantgartner, T., Reynolds, R., Roe, T., e Gilsanz, V. (1996) L’osteopenia nei bambini: valutazione CT. Radiology 198, 781-784.
8. Henderson, R. (1997) Densità ossea e altri possibili elementi premonitori di rischio fratture in bambini e adolescenti con quadriplegia spastica. Dev Med Child Neurol 39, 224-227.
9. Loro, M., Sayre, J., Roe, T., Goran, M., Kaufman, F., e Gilsanz, V. (2000) Identificazione precoce dei bambini predisposti, nel corso della vita, ad un basso picco di massa ossea, e ad osteoporosi. J Clin Endocrinol Metab. 85, 3908-3918.
10. Haas, R.H., Dixon, S.D., Sartoris, D.J., e Hennessy, M.J. (1997) Osteopenia nella sindrome di Rett. J Pediatr. 131(5), 771-774.
11. Nieto, M.A., Candau, R.S., e Prieto, P. (1995) Contributo agli studi sugli accessi nella sindrome di Rett. Analisi di forme critiche in quattro casi. Review Neurology 23, 1185-1189.
12. Glaze, D. (1996) Epilessia. Paper presentato alla IRSA 12th Annual Conference, Boston,
MA: May, 24-27, tape 622-18.
13. Hagberg, B. (1993) Aspetti biologici e clinici della sindrome di Rett. Londra, Mac K Press.
14. Ellaway, C., e Christodoulou, J. (2001) Sindrome di Rett: Caratteristiche cliniche e recenti progressi genetici. Disabil Rehabil 23, 98-106.
15. Leonard, S. (2002) Relazione inaugurale dello studio australiano sulla sindrome di Rett. Telethon institute for child health research, Western Australia.
16. Hunter, K. (1999) Manuale della sindrome di Rett, Washington D.C. U.S.A: International Rett Syndrome Association.
17. Heaney, R.P. (2003) Progressi nella terapia dell’osteoporosi. Clin Med Res. 1(2), 93-99.
18. Leonard, H., Thomson, M., Glasson, E., Fyfe, S., Leonard, S., Ellaway, C., Christodoulou, J., Bower, C. (1999) Profilo di modello metacarpofalangico ed età ossea nella sindrome di Rett:
Ulteriori dati radiologici per la diagnosi. Am J Med Genet. 12(83), 88-95.
19. Motil, K.J., Schultz, R.J., Abrams, S., Ellis, K.J., e Glaze, D.G. (2006) L’assorbimento frazionato del calcio aumenta nelle ragazze con la sindrome di Rett. Journal of pediatric gastroenterology and nutrition. 42(4), 419-426.
20. Budden, S.S., e Gunness, M.E. (2001) Istomorfometria ossea in tre soggetti femminili con la sindrome di Rett. Brain Dev. 23(Suppl 1), S133-137.
21. Hanks, S.B. (2001) Perché terapia fisica ? Rett Gazette Spring,1-2, 4-6.
22. WHO, (1998) Direttive per la valutazione preclinica e I trial clinici nell’osteoporosi. Geneva: WHO, 59.
23. WHO Study Group (1994) Valutazione del rischio di frattura e sua applicazione allo screening per osteoporosi post-menopausa: report. Geneva, WHO, Tech. rep. series.
24. Marshall, D., Johnell, O., e Wedel, H.(1996) Meta-analisi dell’efficacia con cui le misurazioni della densità minerale ossea prevedono l’insorgenza di fratture osteoporotiche. BMJ 312, 1254-1259.
25. Hui, S.L, Gao, S., Zhou, X.H., Johnston, C.C. Jr., Lu, Y., Gluer, C.C., Grampp, S., e Genant, H. (1997) Standardizzazione universale delle misurazioni della densità ossea: un metodo con proprietà ottimali per la calibratura fra strumenti diversi. J Bone Miner Res. 12, 1463-1470.
26. Wilmshurst, S., Ward, K., Adams, J., Langton, C., e Mughal, M. (1996) Condizione della mobilità e della densità ossea nella paralisi cerebrale. Arch Dis Child 75, 164-165.
27. Brown, J.P., Josse, R.G. e The Scientific Advisory Council of the Osteoporosis Society of Canada (2002). Direttive guida nella pratica clinica per la diagnosi e gestione dell’osteoporosi in Canada.
28. Sela, B. (2004) Sulla prevenzione e gestione dell’osteoporosi. Extracted on December, 2004 from web site (In Hebrew): http://tevalife.com/article.asp?id=1556.
29. Qroitaro, S., Volodarsky, A. (2006) Osteoporosi – La malattia e la sua gestione. Extratcted on September, 2006 From internet site (in Hebrew):
http://www.physiotherapist.co.il/reviews/osteoporosis.htm
30. Pfeifer, M., Sinaki, M., Geusens, P., Boonen, S., Preisinger, E., e Minne, H.W. (2004) ASBMR Working Group on Musculoskeletal Rehabilitation Riabilitazione muscolo-scheletrica nell’osteoporosi: analisi. J Bone Miner Res. 19(8), 1208-1214.
31. Reilly, S., e Cass, H. (2001) Crescita e alimentazione nella sindrome di Rett. Disabil Rehabil. 23, 118-128.
32. Budden, S.S. (1995) Gestione della sindrome di Rett: 10 anni di esperienza. Neuropediatrics 26(2), 75-77.
33. Cummings, S.R., Black, D.M., Thompson, D.E., Applegate, W.B., Barrett-Connor, E., Musliner, T.A., Palermo, L., Prineas, R., Rubin, S.M., Scott, .C., Vogt, T., Wallace, R., Yates, A.J., e LaCroix, A.Z. (1998) Effetto dell’alendronate sul rischio di frattura nelle donne con bassa densità ossea ma senza fratture vertebrali: Risultati del Fracture Intervention Trial. JAMA 280, 2077-2082.
34. Zacharin, M., e Cuindy, T. (2000) Sindrome pseudoglioma osteoporosi: Trattamento dell’osteoporosi spinale con bisfosfonati intravenosi. J Pediatr. 137, 410-415.
35. Neer, R.M., Arnaud, C.D., Zanchetta, J.R., Prince, R., Gaich, G.A., Reginster, J.Y., Hodsman, A.B., Eriksen, E.F., Ish-Shalom, S., Genant, H.K., Wang, O., e Mitlak, B.H. (2001) Effetto dell’ormone paratiroide (1–34) sulle fratture e sulla densità minerale ossea nelle donne post-menopausa con osteoporosi. N Engl J Med. 344, 1434–1441.
36. Arnaud, C.D., Roe, E.B., Sanchez, M.S., Bacchetti, P., Black, D.M., e Cann, C.E. (2001) Due anni di ormone paratiroide 1–34 ed estrogeno producono forte aumento della densità ossea in donne osteoporotiche post-menopausa, ed esso diminuisce solo leggermente durante un terzo anno di trattamento con solo estrogeno: Results from a placebo-controlled randomized trial. Bone 28, S277.
37. The Food and Nutrition Board, Institute of Medicine. (1997) Assunzioni dietetiche di riferimento per Calcio, Magnesio, Fosforo, Vitamina D, e Fluoruro. Food and Nutrition Board, Institute of Medicine. Washington, DC, National Academy Press.
38. Chapuy, M.C., Arlot, M.E., Duboeuf, F., Brun, J., Crouzet, B., Arnaud, S., Delmas, P.D., e Meunier, P.J. (1992) Vitamina D3 e calcio per prevenire fratture dell’anca nelle donne anziane. N Engl J Med. 327, 1637–1642.
39. Jones, H., Priest, J., Hayes, W., Tichenor, C., e Nagel, D. (1977) Ipertrofia omerale in risposta all’esercizio fisico. J Bone J Surg Am. 59, 204-208.
40. Gregg, E.W., Cauley, J.A., Seeley, D.G., Ensrud, K.E., Bauer, D.C., per lo Study of Osteoporotic Fractures Research Group (1998) Attività fisica e rischio di frattura osteoporotica in donne anziane. Ann Intern Med. 129, 81-88.
41. Rubin, C., Xu, G., Judex, S. (2001) L’attività anabolica del tessuto osseo, soppressa dall’inattività, viene normalizzata da una breve esposizione a stimoli meccanici di ampiezza bassissima. FASEB J. 15, 2225-2229.
42. Ward, K., Alsop, C., Caulton, J., Rubin, C., Adams, J., Mughal, Z. (2004) Un carico meccanico di bassa ampiezza è osteogenico nei bambini in condizioni di disabilità. J Bone Miner Res. 19(3), 360-369.
43. Caulton, J.M., Ward, K.A., Alsop, C.W., Dunn, G., Adams, J.E., Mughal, M.Z. (2004) Un trial a controllo randomizzato di un programma, con posizione eretta, sulla densità minerale ossea nei bambini non-deambulanti con paralisi cerebrale. Arch Dis Child. 89(2), 131-135.
44. Sinaki, M., Itoi, E., Wahner, H.W., Wollan, P., Gelzcer, R., Mullan, B.P., Collins, D.A., e Hodgson, S.F. (2002) Una muscolatura dorsale più forte riduce l’incidenza delle fratture vertebrali: A prospective 10 year follow-up of postmenopausal women. Bone 30(6), 836-841.
45. Sinaki, M., Khosla, S., Limburg, P.J., Rogers, J.W., e Murtaugh, P.A. (1993) La forza muscolare in donne osteoporotiche a confronto con donne normali. Osteoporos Int. 3, 8-12.
46. Sinaki, M., e Lynn, S.G. (2002) Ridurre il rischio di cadute attraverso un training di postura dinamica proprioceptive in donne osteoporotiche con postura cifotica: A randomized pilot study. Am J Phys Med Rehabil. 81, 241-246.
47. Dargent-Molina, P., Favier, F., Grandjean, H., Baudoin, C., Schott, A.M., Hausherr, E., Meunier, P.J., e Breart, G. (1996) Fattori legati a caduta e rischio di frattura dell’anca : The EPIDOS prospective study. Lancet 348, 145-149.
48. Lotan, M., e Merrick, J. (2004) Gestione della sindrome di Rett con ambiente Snoezelen o multi-sensoriale controllato. Analisi. Int J Adolesc Med Health 16(1), 5-12.
49. Lotan, M., e Shapiro, M. (2005) Gestione di bambini piccoli con disordine Rett nell’ambiente multi-sensoriale controllato (Snoezelen). Brain Dev. 27 (Suppl 1), S88-94.
50. Lotan, M. (2006) Gestione della sindrome di Rett. (Hebrew) Israeli Rett syndrome center, Israel, Tel- Aviv.
51. Fitton A, McTavish D. Pamidronate: Analisi delle sue proprietà farmacologiche ed efficacia terapeutica nella cura della malattia ossea. Drugs J 1991; 41(2):289-318.

